Depuis leur essor dans les années 1990, les différentes techniques d'imagerie cérébrale – qu'il s'agisse de l'imagerie par résonance magnétique (IRM), de la tomographie par émission de positrons (TEP) ou de l'électroencéphalographie (EEG), plus ancienne – ont permis aux chercheurs d'en apprendre énormément sur le fonctionnement du cerveau.
Mais la neuro-imagerie, comme toute méthode
d'investigation, a aussi ses limites. Et depuis quelques années, c'est une
nouvelle technique, encore plus sophistiquée, qui attire de plus en plus
l'attention des explorateurs du cerveau.
Il y a une dizaine d’années, des neuro-scientifiques
ont cherché à utiliser des protéines sensibles à la lumière pour les introduire
dans les neurones de rongeurs, afin de contrôler l’activité électrique des neurones
par impulsions lumineuses : l’optogénétique était née. Par cette approche,
on peut désormais activer et inhiber à volonté des neurones spécifiques, en
observer les conséquences sur le fonctionnement cérébral, et sur le
comportement des individus.
Cette technique
révolutionnaire permet d’allumer et d’éteindre avec de la lumière des populations
de neurones génétiquement modifiés, permettant ainsi non seulement d’étudier le
fonctionnement des circuits neuronaux mais également de développer de nouvelles
approches thérapeutiques pour les troubles neurologiques et psychiatriques. Elle permet de stimuler spécifiquement un type
cellulaire en laissant les cellules voisines intactes.
L’optogénétique est une combinaison entre optique et génie
génétique. Elle est née avec la découverte de la channelrhodopsine – une protéine issue d’une algue unicellulaire.
Cette protéine est sensible à la
lumière et possède la propriété d'être activée par la lumière bleue.
L’idée est de l’introduire dans les neurones, apportée par une fibre optique, pour
qu’elle crée un courant électrique au travers de la membrane cellulaire. Ainsi,
il serait possible de contrôler son activité en excitant ou en inhibant
les cellules via un faisceau lumineux.
La caractéristique de l'optogénétique est
l'introduction de canaux rapidement activés par la lumière et d'enzymes qui
permettent une manipulation des évènements électriques et biochimiques très
précise dans le temps.
Là réside la vraie révolution de
l'optogénétique. Les méthodes
d'imagerie dévoilent le fonctionnement du cerveau à l'échelle macroscopique,
celle des grandes régions cérébrales. L'optogénétique le fait à une échelle
intermédiaire, mésoscopique, correspondant à des assemblées de quelques
centaines, voire quelques dizaines de neurones seulement.
En insérant un ou plusieurs gènes d’opsine dans
certains neurones chez les souris, les biologistes sont maintenant en mesure
d’utiliser la lumière visible pour activer ou désactiver des neurones
spécifiques à leur volonté. Au fil des années, les scientifiques ont adapté les
versions de ces protéines qui répondent aux différentes couleurs, allant du
rouge foncé, au vert, au jaune, au bleu. En mettant différents gènes dans des
cellules différentes, ils utilisent des impulsions de lumière multicolores pour
activer un neurone, puis plusieurs de leurs voisins dans une séquence de temps
précis.
Un cerveau génétiquement modifié
A terme, les spécialistes de l'optogénétique
espèrent que cette technique, en plus d'affiner notre connaissance du cerveau
sain, permettra de mieux guérir le cerveau malade.
Parmi les neurones, certains, dits dopaminergiques – ils libèrent de la dopamine – sont ceux qui dégénèrent dans la maladie de
Parkinson ; d'autres, dits cholinergiques – ils libèrent de l'acétylcholine – sont importants pour l'attention et la mémoire et sont les premiers à s'étioler
dans la maladie d'Alzheimer ; d'autres dits sérotoninergiques – ils
libèrent de la sérotonine – jouent un rôle clef dans le sommeil et ses
troubles.
Avec les méthodes du génie génétique utilisées
dans l'optogénétique, il est tout à fait possible de cibler, parmi les 100
milliards de neurones, l'une ou l'autre de ces populations spécifiques. Par
exemple, les seuls neurones dopaminergiques, relativement peu nombreux. Et de les
sur-activer artificiellement au moyen de flashs lumineux, pour augmenter leur
production de dopamine et réduire ainsi les symptômes de la maladie Parkinson.
La channelrhodopsine-2 (ChR2) : l’ingrédient clé de l’optogénétique
La ChR2 est une protéine découverte, par des
chercheurs allemands en 2003, dans une algue unicellulaire répondant au nom de Chlamydomonas
reinhardtii. Elle ressemble beaucoup au canal sodium, puisqu’elle s’insère
dans la membrane des cellules et peut laisser passer des ions. Mais sa
particularité, c’est que son ouverture
est commandée par la lumière.
Quand la protéine ChR2 reçoit la lumière bleue, elle
change de forme et donne naissance à un petit trou d’environ 6 Angström,
suffisant pour laisser passer les ions à l’intérieur de la membrane. Ceci "active" le neurone produisant de nombreux potentiels d'action.
Les biologistes Ed Boyden et Karl Deisseroth ont
eu l’idée qui est à la base de l’optogénétique : si la ChR2 se comporte
comme un canal répondant à la lumière, on peut l’utiliser pour faire décharger des neurones à la demande.
L’expérience fondatrice a ensuite eu lieu en 2005 à l’université de Stanford.
De nombreux progrès ont été faits, notamment pour
créer artificiellement d’autres protéines similaires à la ChR2, mais agissant
de manière différente, par exemple en jouant le rôle d’inhibiteur au lieu
d’activateur, en réagissant à des couleurs différentes ou avec des temps de
réponse modifiés.
L’avancée la plus importante a été son application
dans les sous-groupes de neurones. L’optogénétique peut être utilisée pour
activer ou désactiver une zone du cerveau et identifier son rôle dans le
comportement, mais aussi cibler des types spécifiques de neurones dans une même
région du cerveau.
Au fil des années, la modification par génie
génétique des protéines existantes, ainsi que la découverte d’autres protéines
sensibles à la lumière, ont permis aux chercheurs d’avoir accès à toute une
panoplie d’outils pour contrôler l’activation des neurones.
Fonctionnement
Le fonctionnement de l’optogénétique repose principalement sur l’insertion, au niveau cérébral, des gènes codant pour une protéine photo-active habituellement d'origine bactérienne appelée opsine.
Le gène d'une micro-algue servant à synthétiser de
l'opsine, une protéine photosensible, est isolé et modifié en laboratoire.
Ce gène est couplé avec un promoteur, petit
fragment d'ADN qui permet d'en limiter l'activation à un certain type de
neurone; en fonction du promoteur choisi, on cible une population spécifique de
neurones.
L'ensemble est inséré dans un virus désactivé qui,
une fois injecté dans le cerveau du cobaye, servira de vecteur à l'intérieur de
celui-ci.
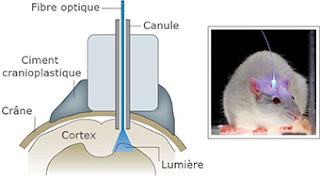
Une fibre optique introduite dans le cerveau
envoie un flash lumineux qui fait réagir les neurones ciblés ayant fabriqué
l'opsine à l'aide du gène.
Il existe différentes opsines réagissant à des
lumières de différentes couleurs; certaines d'entre elles activent le neurone,
d'autres l'inhibent.
Cette technique a des implications réelles d’une grande importance pour le traitement de certaines maladies incurables aujourd'hui encore incluent :
* Elle a servi pour contrôler les crises
d’épilepsie chez des modèles animaux expérimentaux.
* En manipulant des neurones dopaminergiques qui
font partie du circuit de la récompense du cerveau, cela a été en mesure
d’améliorer ou de prévenir la dépendance à la cocaïne ou de traiter les animaux
de la maladie de Parkinson.
* Le contrôle neuronal du sommeil et de l’éveil a
pu être manipulé à volonté. L’activation optogénétique de certains neurones
appelés hypocretins interrompt le sommeil d’un animal profondément endormi,
tandis que l’inhibition optogénétique de ces neurones entraîne un état immédiat
de sommeil profond chez les animaux qui étaient éveillés au moment d’appliquer
le stimulus lumineux. Ces constatations ont jeté les bases pour développer des
médicaments qui modulent le sommeil et pour le traitement des troubles tels que
la narcolepsie.
* Avec l’aide des méthodes optogénétiques, un
groupe de neurones dans l’hypothalamus a été activé sélectivement. L’activation
seule de ces neurones a été suffisante pour induire l’appétit, même chez des
animaux rassasiés et sans entrainement préalable, démontrant qu’un comportement
compliqué tel que l’alimentation peut être contrôlé optogénétiquement. En
revanche, l’activation d’un autre groupe de neurones, situé dans la même région
du cerveau, réduit l’appétit et entraîne une perte de poids en moins de 24
heures, ce qui pourrait être utilisé comme un traitement futur pour les
patients souffrant d’obésité.
* Si il y a une arythmie cardiaque, le cœur pompe
à nouveau le sang au rythme de la lumière. En fait, le premier stimulateur
cardiaque axé sur l’optogénétique a été développé.
*
*
L’optogénétique permet récupérer la mémoire perdue
Des chercheurs du Centre de recherche sur
l'apprentissage et la mémoire du Massachusetts Institute of Technology (MIT), selon
une étude publiée dans la revue Science en mai 2015, sont parvenus à
réactiver la mémoire perdue de rongeurs grâce à la lumière bleue.
Les
chercheurs supputaient l'existence dans le cerveau d'un réseau de neurones qui,
activés pendant la formation d'un souvenir, entraînent des changements
physiques ou chimiques appelés engrammes. Si ces groupes de neurones – appelés
engrammes par extension – sont ensuite réactivés par une image, une odeur ou
une saveur, toute la mémoire enregistrée devrait revenir. Pour démontrer
l'existence de ces groupes de neurones engrammes,
les scientifiques ont utilisé l'optogénétique chez des souris :
technique consistant à ajouter des protéines aux neurones pour leur permettre
d'être activés par la lumière.
 |
| Expérience optogénétique réalisée avec des souris |
Concrètement, un premier groupe de rongeurs
avait été placé dans une cage dite "A" où il avait reçu une décharge
électrique dans les pattes. Placées ultérieurement dans cette même cage, les
souris non traitées ont aussitôt montré leur frayeur indiquant qu'elles se
souvenaient de cette expérience traumatisante. En revanche, les autres,
auxquelles on avait administré de l'anisomycine, empêchant la consolidation de
la mémoire, étaient de toute évidence sans souvenir et sont restées sans
réaction. Par la suite, les chercheurs ont réactivé le processus de
consolidation des synapses par des impulsions lumineuses chez ces souris
amnésiques, lesquelles ont alors recouvré totalement la mémoire de la décharge
électrique. Et même placées dans une autre cage, elles étaient paralysées de
peur.
Cette recherche a permis de dissocier les
mécanismes de stockage de la mémoire de ceux permettant de la former et de la récupérer.
Cela montre que dans certaines formes d'amnésie la mémoire du passé n'a
peut-être pas été effacée, mais est simplement "inaccessible". Ces travaux fournissent un éclairage
surprenant sur la nature de la mémoire et vont stimuler de futures recherches
sur la biologie de la mémoire et de sa restauration clinique.
Une expérience qui apporte un nouvel éclairage sur
le mécanisme biologique de l'amnésie et ouvre potentiellement la voie à des
traitements. Cette recherche fait
avancer la compréhension sur la nature de l'amnésie.
Le calcium révèle les connexions entre les neurones
Des chercheurs de l'University College of London (UCL) ont mis au point une étude publiée
dans Nature Methods en décembre
2016, sur le stockage et la manipulation de l'activité cérébrale qui détermine quels
neurones contribuent à une fonction particulière.
Leur expérience, combinant l’optogénétique avec
une autre méthode de pointe neurotechnologique : le calcium imaging, qui détecte l'activation neuronale en augmentant la concentration de calcium lorsque l'influx nerveux commence. L'équipe a
utilisé un modulateur spatial qui divise la lumière en un hologramme composé de
petits faisceaux, par exemple, pour activer simultanément six neurones
impliqués dans la formation d'un visage souriant.
Applications
cliniques de l’optogénétique
Outil de laboratoire pour étudier les circuits
cérébraux, son application s’est aujourd’hui étendue à nombre de domaines.
Bien que l’optogénétique soit fondamentalement
utilisée sur des souris, on peut faire un transfert à un niveau de basique : les souris
ont beaucoup des structures cérébrales semblable aux humaines, bien que chez l’homme le cerveau
soit agrandi et soit plus complexe.
Les expériences optogénétiques se sont multipliées
à l’aide de protéines microbiennes pour contrôler les mouvements des petits
organismes tels que les mouches des fruits ou des nématodes. Le degré
d’amélioration a été insolite depuis lors. En bref, l’optogénétique peut être
utilisé contre la cécité, pour essayer de récupérer une partie de la perte de
la vision due à des lésions de la rétine. Son application pourrait également se
substituer à des stimulateurs cérébraux pour la maladie de Parkinson,
perfectionner de nouvelles prothèses à une perte auditive, révéler, avec plus
de précision, le mécanisme responsable de sommeil paradoxal et atténuer la
dépendance à la cocaïne.
L’optogénétique ouvre une formidable fenêtre sur
les circuits de neurones qui gouvernent des fonctions-clés. Elle permet de
comprendre les relations entre les émotions primaires et leurs substrats
anatomiques et cellulaires. Les émotions positives et négatives apparaissent
gérées et stockées dans des circuits très chevauchants.
L’optogénétique est utilisée dans le domaine de la
robotique. Des chercheurs de l’université Harvard ont mis au point en
juillet 2015 un raybot, mi-robot mi-organisme vivant, dont la trajectoire
et la mise en mouvement sont contrôlées par l’optogénétique. Constitué d’un
corps en élastomère, d’un squelette en or capable de stocker l’énergie
élastique, l’organisme est recouvert de cellules vivantes de cœur de rats
génétiquement modifiées pour être photosensibles. Exposés à la lumière, les
cardiomyocytes se contractent et les nageoires s’actionnent. Chaque nageoire
est réglée par rapport à un modèle lumineux spécifique, ce qui permet au robot
de tourner. Cette nouvelle technologie laisse présager plusieurs retombées
positives, notamment dans l’ingénierie des tissus. Apprendre à structurer et
contrôler les cellules du cœur pourrait amener à la création de cœurs
artificiels pour la transplantation.
Les premiers essais cliniques ont été lancés
L’optogénétique pour les thérapies humaines est
dans les premiers stades de son développement. Depuis la publication de
premiers travaux sur l’optogénétique au milieu de la dernière décennie,
certains chercheurs ont émis l’hypothèse de l’aide de l’optogénétique chez les
patients, en imaginant par exemple la possibilité d’un interrupteur pour
contrôler la dépression.
Actuellement l’optogénétique n’est pas
suffisamment développée pour être utilisée dans le cerveau des gens, car la
technique nécessite l’insertion d’un câble à fibre optique pour apporter la
lumière dans le cerveau, une méthode qui avant d’être appliquée à l’être humain
doit garantir sa sécurité.
 |
| Cellules du cœur contrôlées par la lumière |
Maintenant, les essais cliniques pourraient être
possibles pour la première fois en raison des progrès technologiques
significatifs. L'implant électroluminescent peut être remplacé par un patch, ce
qui élimine le besoin de chirurgie invasive. Et bien que les virus aient
facilité la manipulation génétique chez les humains, ce n'est pas encore parfait.
Bientôt, de nouveaux outils de modification génétique comme CRISPR (des
familles de séquences répétées dans l'ADN) pourraient constituer la solution la
plus convenable à ce jour, mais seulement si les fonctionnaires relâchent les
réglementations entourant l'utilisation du CRISPR sur les humains.
En novembre 2015, Circuit Therapeutics a annoncé
qu'il avait reçu un contrat de DARPA pour utiliser l'optogénétique pour traiter
la douleur chronique. Les traitements pour cette condition seront probablement
les premiers à être testés dans les essais cliniques. Si les expériences vont
bien, le traitement pourrait être disponible dans une décennie, ouvrant la
porte à l'optogénèse pour être utilisée dans des traitements cliniques pour un
certain nombre d'autres conditions.
Le but est, explique le biochimiste et médecin
Karl Diesseroth, commencer les autres essais pour certaines formes de douleur
superficielle causée par le système périphérique, tels que la douleur causée
par le diabète ou des douleurs post chirurgicales, ou des douleurs causées par des
troubles intestinaux ou du mouvement.
On peut commencer des essais cliniques avec l’optogénétique
pour traiter la douleur chronique, car la thérapie serait moins invasive que
celles nécessitant l’implantation d’électrodes dans le cerveau. Les neurones
touchés par une douleur chronique sont relativement accessibles, car ils
résident au sein et à l’extérieur de la moelle épinière et sont plus faciles à
manipuler que le cerveau. On peut même agir sur les terminaisons nerveuses de
la peau, qui sont encore plus faciles à atteindre.
Le principal défi de thérapies optogénétiques est
comment insérer des gènes qui produisent les canaux d’opsine dans les neurones
humains adultes.
Le deuxième obstacle est comment éclairer les neurones qui
transportent les canaux opsine, d’une manière à allumer ou éteindre le circuit cérébral
désiré. Apporter la lumière directement au cerveau chez l’être humain
nécessiterait une intervention chirurgicale majeure, mais traiter les neurones
périphériques qui transmettent la douleur serait beaucoup moins invasif. Bien
que les neurones à l’extérieur du cerveau, soient plus accessibles, ils sont
également difficiles à activer avec la lumière, car un dispositif émetteur rigide
pourrait endommager le délicat tissu nerveux.
Première thérapie optogénétique pour traiter la cécité
Des neurochirurgiens du centre RetroSense
Therapeutics au Michigan, utilisent pour la première fois chez l’homme, en
février 2016, une nouvelle technique optogénétique pour traiter la maladie
génétique de l’œil – la rétinite pigmentaire – entraînant la mort des cellules
de l’œil.
Pour l’essai clinique 15 patients atteints de
rétinite pigmentaire ont été recrutés. Dans cette maladie, les cellules
sensibles à la lumière de la rétine meurent progressivement.
La thérapie va permettre de créer certaines
cellules nerveuses dans l’œil. Ces cellules, appelées ganglions, sont
sensibles à la lumière. L’œil reçoit des injections de virus qui transportent
de l’ADN sensible à la lumière qui provient d’algues. Si le processus
fonctionne, alors les cellules vont faire exactement la même chose que des
cones et des bâtonnets d’une rétine en bonne santé, à savoir, déclencher un
signal électrique réagissant à la lumière ce qui permet de restaurer une partie
de la vue.
Mais la vision, basée sur des ganglions sensibles
à la lumière, est différente d’une rétine saine. À l’extérieur, la lumière
pourrait être 10.000 fois plus brillante qu’à l’intérieur. Des rétines saines
s’adaptent automatiquement, mais les cellules issues de la thérapie génique ne
sont pas capables de le faire. Pour cette raison, la thérapie devra
s’accompagner d’une sorte de lunettes à vidéo projection qui vont ajuster cette
différence de luminosité.
Prix de la Fondation BBVA Frontiers of Knowledge : aux promoteurs de l’optogénétique
Le prix de La Fondation
BBVA Frontières de la connaissance en Biomédecine a été attribuée pour sa
huitième édition aux neuroscientifiques Edward Boyden, Karl Deisseroth et Gero
Miesenböck, qui ont développé et perfectionné la technique qui utilise la lumière
pour activer ou désactiver les protéines
dans les neurones et ainsi
contrôler son fonctionnement avec une précision sans précédent.
 |
| Edward Boyden-Karl Deisseroth et Gero Miesenbök |
Depuis le développement de cette technique des
milliers de chercheurs ont commencé à utiliser l’optogénétique pour la
recherche sur des fonctions comme le sommeil, l'appétit, la prise de décision,
la perception du temps ou la formation de souvenirs et de comprendre les
mécanismes des maladies telles que l'épilepsie, la maladie de Parkinson, la
dépression et même certaines formes de cécité.
Il a été aussi reconnu aux trois primés leur
capacité à faire connaître et déployer cette technique pou que les scientifiques
du monde entier puisent y accéder et l’utiliser dans leurs recherches.
Ils ont publié leurs travaux en 2005. Depuis, la
technologie a continué de se perfectionner, par exemple avec des protéines qui
réagissent à des rythmes différents et à différents types de lumière, ce qui
élargit l'éventail des fonctions cérébrales qui peuvent être étudiés.
En 2013, le prestigieux Brain Prize a été attribué
aux six inventeurs de l’optogénétique, Ernst Bamberg, Edward Boyden, Karl
Deisseroth, Peter Hegemann, Gero Miesenböck et Georg Nagel, pour l’invention et le développement de
l’optogénétique.
* *
*
Le cerveau humain est notre organe le plus
complexe : 100 milliards de neurones, formant entre eux un milliard de
connexions, le tout se concentrant dans un volume moyen de 1.400 cm3. Trouver
un mécanisme par lequel nous pouvons accéder et “contrôler” son fonctionnement
ouvre des possibilités infinies, non seulement pour le traitement des maladies,
mais aussi pour des champs infinis liés à notre mémoire individuelle et
collective, notre psyché en général.
Les appareils d'imagerie ne permettent pas de
descendre en deçà d'un certain niveau de détails. Spatialement, leur résolution
est de l'ordre du millimètre cube, volume suffisamment grand pour que s'y
agglutinent des dizaines de milliers de cellules nerveuses de tous types. Il
n'en va pas de même avec l'optogénétique. Celle-ci a pour grand avantage de
permettre aux neuroscientifiques de ne marquer que certains neurones et pas les
autres, ce ciblage se faisant grâce à ce que les généticiens appellent un
promoteur.
Bien qu'elle n'ait
émergé qu'au milieu des années 2000, l'optogénétique a déjà profondément
renouvelé le paysage des neurosciences. Mouches à vinaigre, souris et poissons-zèbres ont été désignés volontaires,
avec des résultats étonnants.
C’est une technique qui reste pour l’instant très
invasive. En effet, son application nécessite des approches de thérapie génique
qui consistent à modifier des neurones en injectant un virus codant pour la
channelrhodopsine dans l’aire cérébrale ciblée.
Par ailleurs, cette technique nécessite
l’implantation d’une fibre optique dans le cerveau pour illuminer et activer
les neurones modifiés dans l’aire cérébrale ciblée, ce qui reste à ce jour
difficile, notamment pour les aires cérébrales profondes.
Outre les perspectives de retombées positives
dans le traitement de maladies neurologiques et de création d’organes
artificiels, l’optogénétique, comme les autres modificateurs neuronaux, ouvre
tout une série de questions éthiques liées au contrôle et à la modification de
la mémoire, des souvenirs.
Le potentiel de cette technique est tel que permet
non seulement de comprendre la personnalité et les émotions, mais aussi de trouver
l’origine de l’agressivité et à promouvoir des traitements spécifiques pour
différentes maladies mentales.















Aucun commentaire:
Enregistrer un commentaire